
Die Überwachung der Atmung, des Pulses, der Anzahl der Wach- und Schlafstunden von Frühgeborenen sind wichtige Daten, die dringend benötigt werden.Weiterlesen

Die WHO sagt voraus, dass bis 2050 Infektionen, die durch Mikroorganismen verursacht werden, die gegen herkömmliche Antibiotika resistent sind, die häufigste Todesursache sein könnten. Um sie zu bekämpfen, werden neue Arten von Verbindungen mit spezifischen Wirkmechanismen benötigt. Forscher des HUN-REN-Forschungszentrums für Naturwissenschaften (HUN-REN TTK) haben nun in einer Studie, die in der renommierten Fachzeitschrift Nature Communications veröffentlicht wurde, eine mögliche vielversprechende Richtung aufgezeigt.
Es ist kein Zufall, dass sich die Forscher auf Superbakterien konzentrieren, die gegen herkömmliche Antibiotika resistent sind: Die erste umfassende Analyse der WHO im Jahr 2020 ergab, dass resistente Bakterien im Jahr 2019 1,27 Millionen Todesfälle verursachten, und leider steigt diese Zahl jedes Jahr weiter an. Eine Möglichkeit, Superbakterien zu bekämpfen, ist die sogenannte Phagentherapie, bei der sie durch einen Virus abgetötet werden. Entsprechende Forschungen werden zum Beispiel am Biologischen Forschungszentrum Szeged durchgeführt. Eine andere vielversprechende Möglichkeit ist die Entwicklung von Antibiotika mit völlig neuen Wirkmechanismen.
„Die kleinzelligen Systeme der Bakterien sind unglaublich anpassungsfähig und bilden manchmal über Nacht eine ganze Kolonie.
Jüngste Forschungsergebnisse deuten sogar darauf hin, dass einige Bakterien nanometergroße ‚Alarmbälle‘ von sich selbst ausscheiden, wenn sie sterben, und so das Wissen, das sie zum Überleben brauchen, an ihre Artgenossen weitergeben.
Diese unglaubliche Anpassungsfähigkeit deutet auch darauf hin, dass Superbakterien aus mehreren Richtungen bekämpft werden müssen“, sagte Tamás Beke-Somfai, Leiter der Forschungsgruppe Biomolekulare Selbstorganisation an der Technischen Fakultät des HUN-REN TTK, der zu der neuen Entdeckung befragt wurde.
„Wir haben natürlich vorkommende Peptide in unserem eigenen Körper, die wir antimikrobielle Peptide nennen. Wir haben supramolekulare Strukturen entworfen – eigentlich ein neues Antibiotikum -, die die bakteriziden Mechanismen dieser natürlichen Peptide mit der günstigen Biostabilität nicht-natürlicher Verbindungen kombinieren“, so Tamás Beke-Somfai. Bislang konnten die Forscher nicht wirklich beobachten, wie die Peptide „angreifen“, aber
den Ungarn ist es nun gelungen, mit Hilfe der Transmissions- und Kryo-Elektronenmikroskopie nachzuvollziehen, wie sie sich auf der Oberfläche von Bakterienzellen zu supramolekularen Strukturen anordnen.
„Die Aufnahmen zeigen, dass die sich bildenden Lamellen – wie Messer – die Zellwand durchdringen und in das Innere des Bakteriums eindringen. Durch das Durchstoßen der Zellwand entsteht ein Leck, das schließlich zum Tod des Bakteriums führt. Die Bildanalyse hat auch gezeigt, dass erstaunlich wenige der Lamellen, die die Bakterienzelle durchdringen, ausreichen, um die Zellwand zu beschädigen. Darüber hinaus zeigen die Tests, dass die Peptide das Bakterienwachstum schon bei sehr geringen Konzentrationen hemmen“, fasst der Teamleiter zusammen.
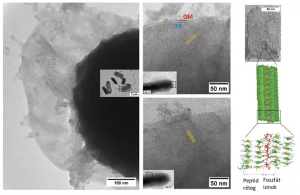
Die Peptidlamellen (gelbe Streifen) bilden sich auf der Oberfläche von Bakterien und durchbrechen die Zellwand (OM und IM), wenn sie in diese hineinwachsen (links). Molekularstruktur von Supramolekülen auf Peptidbasis (rechts). Foto: hun-ren.hu
Die Arbeit der HUN-REN TTK-Forscher ist in mehrfacher Hinsicht innovativ: Erstens haben sie erfolgreich ein Antibiotikum auf Peptidbasis entwickelt, das in situ durch spezifische Bindung an Bakterienzellen aktiviert wird, und zweitens sind sie die ersten, die direkte visuelle Einblicke in die Funktion bakterizider Peptide gewinnen.
Diese Mikroskope ermöglichen einen Einblick in die erstaunliche Welt der räumlichen Struktur großer Makromoleküle, die bis zu Zehntausende von Atomen enthalten können. Sie können den Forschern helfen, noch mehr über Moleküle und Proteine zu erfahren, die für die Physiologie wichtig sind.
via hun-ren.hu, Beitragsbild: pixabay